Для защиты черных и цветных металлов от коррозии и нанесения декоративных покрытий применяют металлические и неметаллические покрытия. Под коррозией понимают процесс разрушения поверхности металлов, приводящий к переходу металла в окислы и соли, соответствующие их естественному состоянию в природных условиях. Различают атмосферную, газовую и жидкостную коррозию. Атмосферная коррозия протекает в условиях образования на поверхности частей изделий тонкой пленки влаги из окружающего воздуха, загрязненного дымовыми газами, содержащими сернистый газ со взвешенными частицами различных солей и пыли. В результате растворения во влажной пленке указанных химически активных веществ на поверхности стальных частей образуется гидрат закиси железа Fe(ОН) 2, переходящий затем в рыхлый гидрат окиси железа Fe(ОН)3.
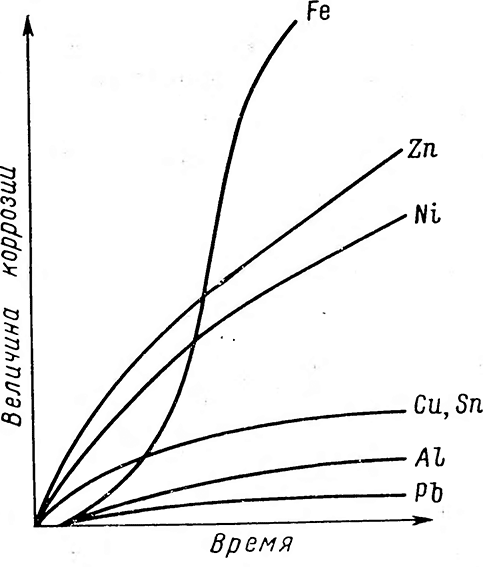
Рис. 1-2
Последний, покрывая сталь рыхлым осадком, не защищает металл от дальнейшего разрушения, а скорее способствует его разрушению. На рис. 1-2 приведены кривые зависимости атмосферной коррозии от времени [28]. Продукт коррозии цинка (хлористый цинк) также гигроскопичен и не защищает металл от разрушения. Газовая коррозия на поверхности металла при высокой температуре и отсутствии конденсации влаги вызывается действиями газов и паров. Жидкостная коррозия различается по видам сред, в которых она образуется (кислотная, щелочная, солевая, морская и речная) и по условиям взаимодействия жидкости на поверхность металла (с полным, неполным и переменным погружениями, капельное и струйное воздействие). Различают еще и межкристаллическую коррозию, распространяющуюся по границам зерен и кристаллов и тем самым воздействующую на механическую прочность металла. Указывается [28], что этот вид коррозии может привести к тому, что монолитная конструкция превращается в порошок.
Современная теория все многообразие коррозионных процессов сводит к химической и электрохимической коррозии.
Кадмий (Cd)—металл с плотностью 8,6 · 103 кг/м3, температурой плавления 320,9° С, температурой кипения 767° С, твердостью по Бринеллю Нв = 20*107 Па, в щелочах не растворяется, с кислотами реагирует, химически стоек к действию морской поды при атмосферных условиях; при наличии сернистого и углекислого газов покрытия менее стойки, чем цинковые.
Медь (Си)—металл с плотностью 8,9*103 кг/м3 температурой плавления 1083°С, температурой кипения 2580°С,твердостью по Бринеллю Нв = 41*107 Па, растворяется в азотной и серной кислотах и аммиаке, со щелочами не реагирует.
В гальванопаре Fe—Си медь является катодом и потому не может быть защитным антикоррозионным покрытием черных металлов. Медные покрытия применяют как подслой при никелировании и хромировании стальных деталей и как защитные — для участков, не подлежащих цементации у цементируемых деталей.
Никель (Ni) —металл с плотностью 8,8 · 103 кг/м3, температурой плавления 1453° С, температурой кипения 2820° С, твердостью по Бринеллю Нв = 60 · 107 Па, растворяется в азотной, серной и соляной кислотах, устойчив в растворах хлористых, сернокислых и азотнокислых солей, в окислительных средах подвергается коррозии. Для черных металлов никель является катодным покрытием и поэтому при наличии микропор в покрытии не защищает основной металл от коррозии. Поэтому никелевые покрытия черных металлов могут быть защитными лишь при определенной толщине слоя, который становится непроницаемым для влаги окружающего воздуха (толщина свыше 20 мкм [14]). При никелировании черных металлов непроницаемость защитного покрытия увеличивают за счет медного подслоя.
Хром (Сг) —металл с плотностью (6,9-:-7,1) · 103 кг/м3, температурой плавления 1900° С, температурой кипения 2600° С, твердостью по Бринеллю Нв = (300-:-1100) · 107 Па (электролитического), растворяется в соляной и серной кислотах, стоек к действию азотной кислоты, серы и ее соединений, растворов щелочей. Хром не защищает черные металлы от коррозии, и для обеспечения антикоррозийное™ применяют двух- (Си—Сг) и трехслойные (Си—Ni—Сг) покрытия. Хромовые покрытия отличаются высокой твердостью, а следовательно, износо-жаростойкостью и химической стойкостью.
Олово (Sn) —металл с плотностью 7,3- 103 кг/м3, температурой плавления 231,9° С, температурой кипения 2600° С, твердостью по Бринеллю Нв = 7,6· 107 Па, не окисляется под действием влажного воздуха, слабо реагирует с растворами соляной, серной и азотной кислот, не растворяется в крепкой азотной кислоте, устойчив к действию сернистых соединений, растворяется в нагретых крепких растворах щелочей. Необходимо учитывать, что белое олово при низких температурах (ниже —18° С) становится серым с плотностью 6,75 · 107 кг/м3, превращаясь в порошок. Это явление получило название «оловянной чумы». Лужение является подготовительной операцией перед пайкой, применяют его для покрытия мест контактных соединений токопроводов, для предохранения от окисления токопроводов и контактов аппаратов.
Серебро (Ag)—благородный металл с плотностью 10,5X Х103 кг/м3, температурой плавления 960,8° С, температурой кипения 2180° С, твердостью по Бринеллю в отожженном состоянии Н0 = 25-107 Па, в присутствии кислорода и влаги взаимодействует с сероводородом, образуя черно-серую пленку сернистого серебра, тускнеет под воздействием хлора.
Таблица 1-13

К неметаллическим покрытиям относятся лакокрасочные покрытия, минеральные масла, используемые как защитные смазки, гуммирующие материалы в виде листовой вулканизированной резины, слоистые пластики, синтетические материалы, фосфатные пленки. Часто эти покрытия совмещают функции зашитые и декоративные.
Фосфатные пленки, отличаясь малой толщиной (3—10 мкм), практически не изменяют сборочных размеров деталей, изготовляемых не выше третьего класса точности. Это позволило, например, нарезание резьбы фосфатируемого стального крепежа производить нормальным режущим инструментом. Фосфатная пленка отличается высокоразвитой микропористой структурой и высокой адгезионной способностью. Это делает ее особенно пригодной к пропитке различными маслами, а также и к использованию в качестве грунтового слоя под лакокрасочные покрытия.
Фосфатный грунтовый слой примерно в десять раз увеличивает коррозионную стойкость лакокрасочного покрытия стальных изделий по сравнению с лакокрасочными покрытиями на обычном грунте.
Обладая хорошими электроизоляционными свойствами, фосфатная пленка препятствует образованию на поверхности металла очагов электрохимической коррозии. Наличие проколов в пленке обычно локализует распространение ржавчины только размером проколов. Электрическая прочность фосфатной пленки — около 250 В, при пропитке же ее изоляционными лаками этот уровень может быть поднят до 1000 В; одновременно повышается и коррозионная стойкость пленки к различным средам. В табл. 1-14 по данным [24] приводится уровень защитных свойств фосфатного покрытия стальной поверхности в зависимости от вида пропитки при воздействии на пленку 3%-ного раствора поваренной соли при 20° С.
Таблица 1-14
Вид пропитки | Стойкость, ч |
Без пропитки | 4—6 |
Пропитка веретенным маслом | 40—48 |
Пропитка расплавленным парафином | 60 |
Покрытие масляным лаком горячей сушки в два слоя | >500 |
Фосфатирование стальных деталей не затрагивает их магнитных свойств, но наводороженный поверхностный слой деталей обладает повышенной хрупкостью, тем самым ограничивая область применения этого покрытия. Механическая прочность и эластичность фосфатной пленки невысоки; это покрытие также неустойчиво и к истиранию. В кислотах и щелочах покрытие без пропитки маслами или лаками растворяется. Пленка выдерживает кратковременный нагрев до 400—500° С, морозостойкость до —75° С.
Наиболее качественное покрытие наблюдается у поделочных низкоуглеродистых сталей; у низкоуглеродистых сталей пленка удовлетворительного качества, а у высоколегированных сталей пленка образуется с трудом, она обладает пониженным адгезионным свойством и неравномерна по толщине. Из цветных металлов фосфатирование подвергают алюминий, магний и их сплавы, а также кадмированные и оцинкованные детали.


